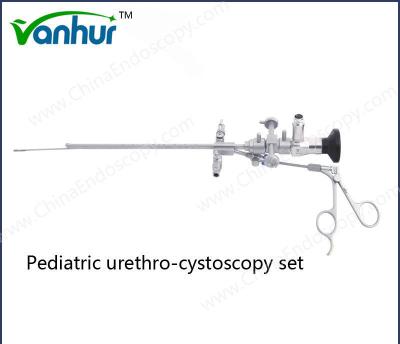
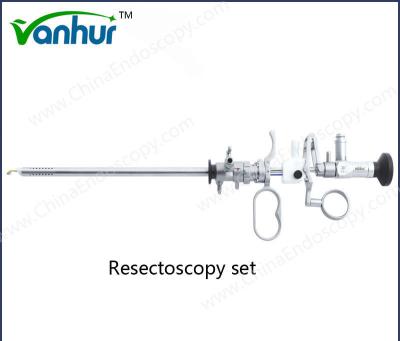
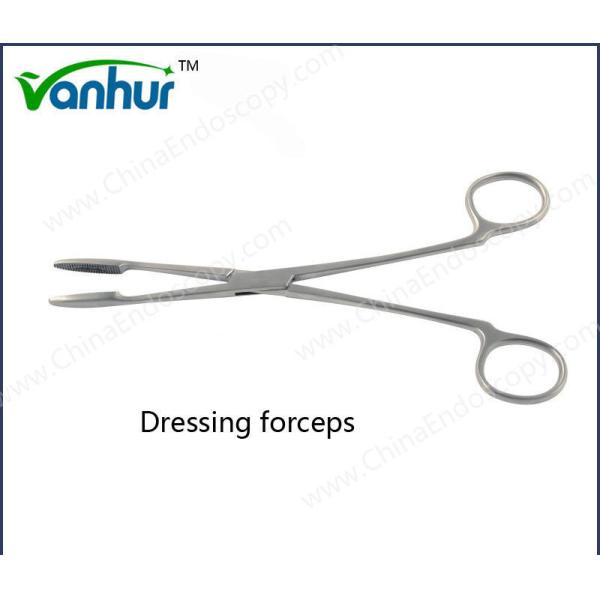
Pedido personalizado Equipamento de Urologia Força-Força de Biópsia rígida para opção de design reutilizável
1 Introdução:
Se procura instrumentos médicos de cirurgia minimamente invasiva com boa qualidade, preço competitivo e serviço fiável, a Wanhe Medical está a fabricá-los para si.Fornecemos instrumentos laparoscópicos gerais e profissionais com CE, aprovado pela FDA.
2 Especificações
Adotar 3Cr13, 304, 630 material de aço inoxidável
Construção resistente
Resistentes à corrosão
Alta durabilidade
3 Embalagem e transporte:
| Detalhes da embalagem: |
Saco poliéster e caixa especial de papel à prova de choques. |
| Detalhes da entrega: |
Por via aérea |

Perguntas frequentes
Procedimentos de controlo da qualidade da produção de dispositivos médicos
Os procedimentos de controlo da qualidade da produção de dispositivos médicos foram divulgados.
The purpose of the medical device production quality control procedures is to conduct prescribed inspections and tests on the entire production process to ensure that uninspected and unqualified products are not put into use, processados ou enviados.
O ambiente de produção deve ser limpo e satisfazer as necessidades de qualidade do produto e as normas técnicas pertinentes.deve assegurar que o ambiente externo da fábrica não afeta a qualidade do produto, e a verificação deve ser efectuada quando necessário.
As empresas devem formular procedimentos de inspecção dos produtos acabados baseados em normas obrigatórias e requisitos técnicos dos produtos registados ou registados, requisitos de entrega dos produtos,e normas de controlo interno da empresa. The finished product inspection procedures should determine the verification/confirmation/monitoring/measurement/inspection/test procedures and requirements for routine control of finished products to ensure that the production process is controlled.
Os procedimentos de controlo da qualidade da produção de dispositivos médicos foram claramente divulgados, and their content covers all aspects from the production environment to the finished product inspection to ensure that the quality of medical devices meets the requirements of relevant laws and regulations and standards.
Quais são as etapas específicas de aplicação dos procedimentos de controlo da qualidade da produção de dispositivos médicos?
De acordo com os resultados, as etapas de execução específicas do procedimento de controlo da qualidade da produção de dispositivos médicos podem ser resumidas a partir dos seguintes aspectos:
Planejamento e implementação de hardware empresarial: é mencionado que os fabricantes de dispositivos médicos precisam planejar e implementar edifícios, instalações e equipamentos de fábricas,que é a base do controlo da qualidade do produtoIsto inclui o estabelecimento e equipamento de locais de produção adequados, condições ambientais e equipamento de produção.
Seguir as "Especificações de Gestão da Qualidade da Produção de Dispositivos Médicos": destacam que as empresas devem reforçar o controlo de qualidade de todo o processo de realização do produto,Os processos de aquisição e produção, as well as the management of finished product release in accordance with the requirements of the "Medical Device Production Quality Management Specifications" and its appendix issued by the State Food and Drug Administration.
Procedimentos de controlo na fase de concepção e desenvolvimento:Empreendimentos devem estabelecer e documentar procedimentos de controlo do projecto para planear e controlar o processo de concepção e desenvolvimento de dispositivos médicos.
Controle do processo de produção: descreve as etapas específicas para que o departamento de engenharia de produção organize a produção de acordo com o plano de produção,Incluindo a emissão de desenhos e "Ordem de Trabalho" ao director da oficina, indicando a quantidade de transformação e o número do produto/do lote, bem como outras informações e horas de trabalho na "Ordem de Trabalho",exigir aos trabalhadores que o concluam no prazo das horas de trabalho especificadas.
Auditoria interna: É mencionado que, a fim de efetivamente realizar auditorias internas de dispositivos médicos,É essencial elaborar uma lista de verificação de auditoria abrangente para garantir que todos os aspectos relevantes sejam abrangidos e para ajudar a manter a coerência entre as auditorias.
As etapas de implementação do procedimento de controlo da qualidade da produção de dispositivos médicos incluem o planeamento e a implementação do hardware da empresa,Conformidade com as "Especificações de Gestão da Qualidade da Produção de Dispositivos Médicos", procedimentos de controlo na fase de concepção e desenvolvimento, controlo dos processos de produção e auditorias internas.
Como formular procedimentos de inspecção dos produtos acabados com base em normas obrigatórias e requisitos técnicos do produto?
As etapas para formular procedimentos de inspecção dos produtos acabados baseados em normas obrigatórias e requisitos técnicos do produto são as seguintes:
Clarificar as normas obrigatórias: Em primeiro lugar, a empresa precisa de compreender e clarificar as normas obrigatórias aplicáveis.,A Comissão propõe que se proceda a uma análise dos problemas de segurança social e de segurança social.
Verificar os requisitos técnicos do produto: a empresa deve verificar os requisitos técnicos do produto registados ou registados.Terminologia e apêndicesOs requisitos técnicos do produto são os elementos técnicos essenciais das normas do produto e devem ser seguidos por princípios como as características de desempenho, a verificabilidade, a mensurabilidade, a segurança e a segurança.viabilidade, e verificabilidade.
Preparação dos procedimentos de inspecção dos produtos acabados: de acordo com as normas obrigatórias e os requisitos técnicos do produto,As empresas devem formular procedimentos detalhados de inspecção do produto acabadoOs procedimentos devem incluir pelo menos:
Nome, especificação e modelo dos produtos acabados
Elementos e métodos de verificação/confirmação/monitorização/medição/inspeção/ensaios
Instrumentos e equipamentos aplicáveis
Procedimentos e planos de amostragem
Critérios de aceitação
Normas de referência/medidas de referência
Garantir a racionalidade e a operabilidade: ao preparar os procedimentos de inspecção dos produtos acabados, é necessário assegurar que estes cumprem os requisitos das normas obrigatórias,e que os indicadores de desempenho são razoáveis, e que os métodos de inspecção sejam repetíveis e operáveis.
Controlo da qualidade e libertação: as empresas devem proceder ao controlo da qualidade de acordo com os procedimentos de inspecção do produto acabado e libertar os produtos acabados após terem cumprido todos os requisitos.
Quais são os problemas comuns de qualidade e as suas soluções no processo de produção de dispositivos médicos?
Os problemas comuns de qualidade e as suas soluções no processo de produção de dispositivos médicos são os seguintes:
Qualidade instável das matérias-primas:
Solução: Estabelecer um mecanismo rigoroso de inspecção das matérias-primas para garantir que todas as matérias-primas sejam submetidas a uma inspecção e certificação de qualidade rigorosas antes de entrarem na linha de produção.
Manipulação de produtos defeituosos durante o processo de produção:
Solução: registar, classificar, avaliar e lidar com produtos defeituosos, incluindo retrabalho, desmantelamento e outras medidas.Estabelecer um sistema completo de rastreabilidade do produto para registar as informações essenciais no processo de produção, de modo a que a causa possa ser rapidamente localizada quando surgirem problemas..
Controle de qualidade no processo de embalagem:
Solução: A embalagem dos dispositivos médicos é um elo importante no processo de produção, envolvendo vários pontos de fluxo do processo.Pode haver riscos em cada transferência e em cada ponto de fluxo de processoPor conseguinte, é necessário um controlo de qualidade rigoroso em cada ligação para garantir que o processo de embalagem cumpre os requisitos das "Especificações de Gestão da Qualidade da Produção de Dispositivos Médicos".
Gestão insuficiente do equipamento e gestão insuficiente dos dados:
Solução: utilizar o sistema MES (Sistema de Execução de Fabricação) para cobrir soluções completas de produção, desde matérias-primas médicas até gestão de armazém, inspecção de qualidade, gestão da qualidade,Gestão da produção, gestão de equipamentos, etc. Através da sincronização de interfaces de software e hardware, gestão de análise de dados e gestão electrónica de kanban, ajudar as empresas a melhorar os mecanismos de qualidade,Realizar a visualização da fábrica, a rastreabilidade completa dos processos de produção dos produtos e o arquivamento dos dados de produção.
Gestão dos processos essenciais e dos processos especiais:
Solução: a empresa deve preparar procedimentos do processo de produção, instruções de funcionamento, etc., clarificar os principais processos e os processos especiais,e verificar ou confirmar os parâmetros importantes destes processos para garantir a qualidade do produto.
Planeamento e programação de produção irracionais:
Solução: formular planos e calendários de produção razoáveis de acordo com a procura do mercado e os recursos da empresa,Assegurar que a transformação e a fabricação são efectuadas em conformidade com o fluxo do processo e os procedimentos operacionais, e processar e montar matérias-primas para garantir que a qualidade do produto atenda às normas.
Quais são as normas de limpeza e os requisitos técnicos para o ambiente de produção dos dispositivos médicos?
De acordo com os resultados, as normas de limpeza e os requisitos técnicos para o ambiente de produção de dispositivos médicos refletem-se principalmente nos seguintes aspectos:
Nível de limpeza do ambiente de produção: It points out that the setting of the cleanliness level of the production environment of primary packaging materials that are in direct contact with the use surface of implantable sterile medical devices and are used without cleaning should follow the same principle as the cleanliness level of the product production environmentIsto mostra que o nível de limpeza do ambiente de produção deve ser definido de acordo com o tipo e as exigências dos dispositivos médicos produzidos.
Disponibilização da instalação e controlo ambiental: sublinha a racionalidade da disposição global da instalação e não deve ter efeitos adversos na área de produção de dispositivos médicos estéreis,especialmente a área limpaAo mesmo tempo, é mencionado que a sala limpa (área) é um ambiente indispensável no processo de produção de dispositivos médicos estéreis e implantáveis,e o seu nível de controlo ambiental afeta directamente a qualidade do produto.
Requisitos de esterilidade e de purificação do processo de produção:É salientado que a GMP melhorou de forma abrangente o nível de limpeza do ambiente limpo da produção de dispositivos médicos estéreis, e tem requisitos mais rigorosos para a esterilidade e a purificação do processo de produção, incluindo a exigência de monitorização dinâmica.
Sistema de gestão da qualidade: It is mentioned that medical device manufacturers should establish and improve a quality management system that is suitable for the medical devices they produce in accordance with the requirements of the medical device production quality management specifications, e assegurar o seu funcionamento eficaz.
As normas de limpeza e os requisitos técnicos para o ambiente de produção de dispositivos médicos incluem, entre outros:Organização racional da área da fábrica para evitar efeitos adversos na área de produção, satisfazer os requisitos de esterilidade e de purificação no processo de produção e estabelecer e manter um sistema eficaz de gestão da qualidade.
Quais são os efeitos do procedimento de controlo da qualidade da produção de dispositivos médicos sobre as normas de controlo interno da empresa?
O impacto do procedimento de controlo da qualidade da produção de dispositivos médicos nas normas de controlo interno da empresa reflete-se principalmente nos seguintes aspectos:
Clarificar as responsabilidades e as qualificações do pessoal:O procedimento de controlo da qualidade exige que a empresa estabeleça um departamento de inspecção de produtos claro e estipule as qualificações e os procedimentos operacionais do pessoalIsto ajuda a assegurar que cada ligação tenha uma pessoa dedicada responsável e as capacidades profissionais correspondentes, melhorando assim a eficiência geral da gestão e a qualidade do produto.
Procedimentos operacionais normalizados: Os procedimentos de controlo da qualidade incluem requisitos para a utilização e calibração dos instrumentos e equipamentos de inspecção, bem como procedimentos para a liberação do produto.Estes procedimentos operacionais normalizados podem reduzir os erros humanos e garantir que cada etapa da produção cumpra os padrões, melhorando assim a segurança e a fiabilidade dos produtos.
Gestão de riscos: a norma ISO 13485 exige que os fabricantes de dispositivos médicos implementem um processo de gestão de riscos para identificar, analisar,avaliar e controlar os riscos associados aos seus produtosEsta abordagem sistemática ajuda as empresas a identificar prontamente potenciais problemas e a tomar medidas durante o processo de produção para evitar acidentes graves.
Auditorias e avaliações internas: O procedimento de controlo da qualidade inclui também auditorias e avaliações internas para assegurar o funcionamento eficaz do sistema de gestão da qualidade.Através de auditorias e avaliações internas periódicas, as empresas podem identificar e corrigir prontamente os problemas existentes e manter a melhoria e otimização contínuas do sistema de gestão da qualidade.
Estabelecer padrões baseados na situação real da empresa: ao formularem procedimentos de controlo da qualidade, as empresas devem estabelecê-los com base na sua situação real e nos padrões nacionais e da indústria.Isto ajuda as empresas a adaptarem-se melhor às alterações do mercado e aos requisitos regulamentares e a assegurar a ciência e a racionalidade das suas normas de controlo interno.
Para mais fotos e detalhes, por favor contacte-me:
Nome da empresa: Tonglu Wanhe Medical Instruments Co., Ltd.
Vendas: Emma
Tel: +86 571 6991 5082
Número do telemóvel: +86 13685785706